В. П. СКУЛАЧЕВ
Московский государственный университет им. М.В. Ломоносова
Клеточным дыханием называют поглощение кислорода (О2) живыми клетками. Это явление присуще всем организмам, живущим в содержащей кислород среде (то есть в аэробных условиях). Более 90% поглощающегося кислорода восстанавливается до воды путем присоединения к О2 четырех электронов и четырех протонов. Процесс катализируется ферментами оксидазами:
(1) О2+
4e- + 4H+
![]() 2H2O
2H2O
Гораздо более редкий случай - внедрение одного из атомов молекулы кислорода в то или иное органическое соединение. Эти процессы идут под действием оксигеназ. Кроме того, около 2% поглощаемого кислорода превращаются в супероксид (O2-) в химических (неферментативных) реакциях одноэлектронного восстановления O2 . При этом донорами электрона служат семихинон и некоторые другие промежуточные продукты дыхания [5].
Важнейшим представителем оксидаз является цитохромоксидаза (другие названия: цитохром с-оксидаза, цитохром aa3). Этот фермент локализован во внутренней мембране митохондрий животных, растений и грибов, а также в мембране некоторых аэробных бактерий. Цитохромоксидаза - конечный фермент дыхательной цепи, последовательности ферментов и коферментов - переносчиков электронов от субстратов дыхания к О2 :

где NADН - восстановленный никотинамидадениндинуклеотид, KoQ и KoQO2 - окисленная и восстановленная формы кофермента Q.
Как видно из реакции (2), дыхательная цепь состоит из трех основных этапов: 1) окисления NADН посредством KoQ, 2) окисления KoQO2 цитохромом с и 3) окисления восстановленного цитохрома с кислородом. Эти три этапа катализируются соответственно ферментами NADН-KoQ-редуктазой, KoQO2-цитохром с-редуктазой и цитохромоксидазой.
При окислении NADН превращается в NAD+. Регенерация NADН из NAD+ осуществляется за счет окисления субстратов дыхания, как правило органических кислот, получающихся при расщеплении углеводов, жиров и аминокислот. Субстраты дыхания служат также источником протонов, используемых при образовании воды в реакции (1).
Различные функции, исполняемые клеточным дыханием, могут быть разбиты на четыре группы: 1) запасание энергии в конвертируемой форме АТФ или протонного потенциала [6, 7]; 2) рассеяние энергии в виде тепла; 3) образование веществ, полезных для клетки; 4) уборка веществ, присутствие которых в клетке нежелательно.
Эта функция является, безусловно, ведущей в количественном отношении: большая часть кислорода поглощается клеткой, чтобы окислить субстраты дыхания сопряженно с образованием протонного потенциала. В случае митохондрий полученный таким образом протонный потенциал используется преимущественно для синтеза АТФ из АДФ и H3PO4 под действием фермента Н+-АТФ-синтазы [6, 7]:

Гидролиз АТФ используется для обеспечения различных энергоемких процессов, таких, как биосинтез веществ, мышечное сокращение и внутриклеточное движение, транспорт ионов через внешнюю мембрану клетки и т.д. У бактерий некоторые эти функции поддерживается непосредственно протонным потенциалом [6].
О масштабах процесса, изображенного реакцией (3), говорят следующие цифры. Митохондрии взрослого человека среднего роста и веса перекачивают через свои мембраны около 500 г ионов Н+ в день, образуя протонный потенциал. За это же время Н+-АТФ-синтаза производит около 40 кг АТФ из АДФ и фосфата, а процессы, использующие АТФ, гидролизуют всю эту массу АТФ назад в АДФ и фосфат.
Очевидное значение энергозапасающей функции и размах связанных с ней событий породили ошибочное представление, что роль дыхания в клетке исчерпывается его способностью образовывать АТФ. Однако более пристальный анализ этой проблемы показывает, что существуют и иные функции клеточного дыхания, зачастую альтернативные фосфорилированию АДФ. Наиболее очевидный случай - образование тепла в целях терморегуляции.
Почти вся энергия, извлекаемая при дыхании путем окисления субстратов кислородом, в конечном итоге превращается в тепло. Расщепляются синтезированные ранее вещества, нагревается кровь за счет ее трения о стенки кровеносных сосудов, образуется тепло при внутриклеточных движениях, сопряженных с расходом АТФ. Даже совершение мышечной работы для перемещения, например, каких-то тяжелых предметов имеет КПД всего около 20%, а все остальное уходит в тепло. Поэтому, чтобы согреться на холоде, достаточно было бы в принципе просто активировать фосфорилирующее дыхание и процессы расщепления АТФ. Иногда так и происходит: дрожь на сильном морозе не что иное как мышечные сокращения, чтобы расщепить АТФ до АДФ и H3PO4 посредством АТФазы актомиозина и тем самым активировать фосфорилирующее дыхание. Никакой полезной работы при этом не совершается, и вся энергия дыхания превращается в тепло. Однако такой способ образования тепла вряд ли оптимален, поскольку не достигается одна из целей терморегуляции - вывести биологические процессы из зависимости от окружающей температуры. Кроме того, громоздок сам механизм образования тепла: сначала приходится накапливать энергию в АТФ внутри митохондрий, потом транспортировать этот АТФ в цитозоль, там расщеплять его до АДФ и фосфата, которым предстоит путь обратно в митохондрии. Неудивительно, что при холодовой адаптации животных дрожь постепенно исчезает, сменяясь каким-то другим способом образования тепла, когда дыхание по-прежнему активировано, а мышечных сокращений не происходит.
Наши опыты на стриженых голубях, лишенных главного средства физической
терморегуляции - оперения, показали, что повторное выдерживание животных на
холоде (- 20![]() C с вентилятором) вызывает отключение дыхания от механизма синтеза АТФ в мышечных митохондриях (мы назвали это явление
терморегуляторным разобщением дыхания и фосфорилирования).
Подобным образом голубю удается поддерживать температуру тела около 37
C с вентилятором) вызывает отключение дыхания от механизма синтеза АТФ в мышечных митохондриях (мы назвали это явление
терморегуляторным разобщением дыхания и фосфорилирования).
Подобным образом голубю удается поддерживать температуру тела около 37![]() C (при
норме 41,5
C (при
норме 41,5![]() C) в течение нескольких часов охлаждения. Интересно, что при первом
охлаждении, сопровождающемся выраженной дрожью, разобщение не успевает
развиться и катастрофическое падение температуры происходит уже через 20-25
мин. Налицо механизм адаптации животного к низкой температуре.
C) в течение нескольких часов охлаждения. Интересно, что при первом
охлаждении, сопровождающемся выраженной дрожью, разобщение не успевает
развиться и катастрофическое падение температуры происходит уже через 20-25
мин. Налицо механизм адаптации животного к низкой температуре.
Дальнейший анализ этого явления показал, что дыхание мышечных митохондрий адаптированных животных по-прежнему образует протонный потенциал, но, образовавшись, он тотчас рассеивается из-за повысившейся проводимости мембраны для протонов (рис. 1). В итоге дело до АТФ просто не доходит, так как вся энергия растрачивается в тепло еще до того, как включится Н+-АТФ-синтаза.
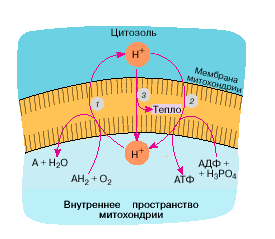
Рис. 1. Образование и использование протонного потенциала в митохондриях животных: 1 - откачка ионов Н+ из внутреннего объема митохондрий наружу посредством ферментов дыхательной цепи сопряженно с окислением кислородом дыхательных субстратов (АН2) в продукты (А); 2 - возвращение ионов Н+ внутрь митохондрий посредством Н+-АТФ-синтазы сопряженно с синтезом АТФ из АДФ и фосфата; 3 - возвращение ионов Н+ внутрь митохондрий с образованием тепла, минуя Н+-АТФ-синтазу
Причиной повышения протонной проводимости митохондриальной мембраны служит резкое возрастание концентрации свободных жирных кислот, прежде всего пальмитиновой и стеариновой, которые образуются при липолизе, то есть гидролизе нейтрального жира ферментом липазой.
Активация липазы - один из компонентов адаптации к холоду. Жиры - наиболее калорийный субстрат дыхания, а липолиз - первая стадия мобилизации жиров. Образующиеся в результате жирные кислоты оказываются не только "топливом", но и важнейшим регулятором - разобщителем дыхания и фосфорилирования, упрощающим путь превращения энергии дыхательных субстратов в тепло.
Механизм разобщающего действия жирных кислот показан на рис. 2. На внешней поверхности митохондриальной мембраны анион жирной кислоты (RCOO-) присоединяет ион Н+, откачиваемый из митохондрий ферментами дыхательной цепи. Получающаяся при этом протонированная форма жирной кислоты (RCOOH) пересекает мембрану и диссоциирует на ее внутренней поверхности, давая RCOO- и H+. Последний компенсирует внутри митохондрий нехватку ионов Н+, удаляемых оттуда дыхательной цепью. Образующийся анион RCOO- возвращается наружу при участии митохондриальных белков - анионных переносчиков, в частности АТФ / АДФ-антипортера. Главная функция АТФ / АДФ-антипортера состоит в обмене аниона внешнего (цитозольного) АДФ на внутримитохондриальный анион АТФ, образованный Н+-АТФ-синтазой. Антипортер чрезвычайно разборчив в отношении гидрофильных анионов и безошибочно отличает, например, АДФ от гуанозиндифосфата (ГДФ). Однако в отношении гидрофобных анионов такой избирательности не наблюдается. Вот почему АТФ / АДФ-антипортер оказывается способным к транспорту анионов жирных кислот.
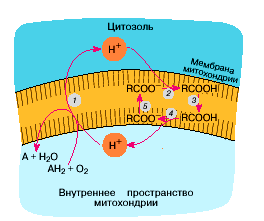
Рис. 2. Перенос ионов Н+ через мембрану митохондрий жирными кислотами: 1 - откачка ионов Н+ дыхательной цепью; 2 - использование откачанных ионов Н+ для протонирования аниона жирной кислоты (RCOO-); 3 - диффузия протонированной жирной кислоты (RCOOH) к внутренней поверхности митохондрий; 4 - диссоциация RCOOH с образованием RCOO- и иона Н+ внутри митохондрии; 5 - перенос RCOO- посредством АТФ / АДФ-антипортера или разобщающего белка к наружной поверхности митохондриальной мембраны
Существует особая ткань, специализирующаяся на теплопродукции посредством разобщенного дыхания. Это бурый жир. Своим названием он обязан необычайному обилию митохондрий (они коричневого цвета). Митохондрии бурого жира имеют большой избыток дыхательных ферментов по сравнению с Н+-АТФ-синтазой. Около 10% всех белков этих митохондрий приходится на так называемый разобщающий белок (другое название - термогенин). По своей структуре разобщающий белок близок к АТФ / АДФ-антипортеру, отличаясь от него тем, что он неспособен к транспорту нуклеотидов, но сохранил способность переносить анионы жирных кислот. Клетки бурого жира содержат помимо митохондрий много жировых капель, так что активация липолиза в ответ на охлаждение организма приводит к появлению особенно больших количеств свободных жирных кислот, которые окисляются митохондриями и разобщают собственное окисление от фосфорилирования.
В самое последнее время белки, напоминающие разобщающий белок бурого жира, были обнаружены также и в других тканях. Один из них значительно увеличивается в количестве при двухдневном выдерживании крыс на холоде (+ 6њC). Можно полагать, что при холодовой адаптации разобщающий белок включается наряду с АТФ / АДФ-антипортером в транспорт анионов жирных кислот через митохондриальную мембрану.
Помимо охлаждения существуют по крайней мере еще два физиологических способа вызвать разобщение дыхания и фосфорилирования в буром жире. Один из них специфичен для спящих зимой животных. При зимней спячке температура тела снижается до 4њC, а при пробуждении быстро возрастает до нормальной. Оказалось, что прежде всего разогревается бурый жир, который облегает артерии, питающие кровью головной мозг. Разогрев сопровождается разобщением дыхания и фосфорилирования под действием жирных кислот.
Активация разобщающего белка описана также у животных, потребляющих избыток пищи, например у крыс на "ресторанной диете", когда животным предлагается без ограничения вкусная и разнообразная пища. Избыток пищи, поступающий в организм, сжигается в разобщенных митохондриях бурого жира без всякого накопления энергии.
Терморегуляторное разобщение описано не только у животных, но также и у растений. Еще в 1788 году Ж.Б. Ламарк обратил внимание на то, что в холодную погоду цветы некоторых лилейных на ощупь кажутся гораздо теплее, чем стебли и листья. Выяснилось, что разогрев, необходимый для испарения эфирных масел, привлекающих насекомых, достигается за счет мощного ускорения дыхания, обусловленного его разобщением от фосфорилирования. Параллельно происходит активация исходно несопряженной дыхательной цепи, которая у растений сосуществует с той, что была изображена выше (см. реакцию (2)). В результате скорость дыхания возрастает до 100 раз, а градиент температуры между цветком и воздухом может составлять 35њC (+15њC в цветке при - 20њC в воздухе), как это было описано у растения под названием "восточная капуста".
Образование тепла в организме животных и растений может осуществляться не только за счет работы дыхательной цепи. Занятный пример использования несопряженного дыхания для образования тепла описан у жука-бомбардира. В задней части тельца этого насекомого есть две изолированные камеры, в одной из которых содержится субстрат дыхания (гидрохинон), а в другой - дыхательный фермент гидрохиноноксидаза. При появлении врага жук поворачивается к нему задом, ломает мышечным усилием перегородку между камерами и тем самым запускает реакцию окисления гидрохинона кислородом. Процесс протекает столь бурно, что вода в камерах вскипает, а враг получает в физиономию струю перегретого пара из полой трубки - хвоста жука-бомбардира. Интересно, что существует другой жук, внешне искусно подделывающийся под жука-бомбардира, но не вооруженный "паровым пистолетом". В минуту опасности он встает в ту же позу, что его изобретательный собрат, чтобы испугать противника в расчете на то, что тот когда-нибудь уже имел дело с настоящим жуком-бомбардиром.
Мы рассмотрели энергетические функции дыхания: накопление энергии в форме протонного потенциала и АТФ и ее рассеяние в виде тепла. На этом примере, разобранном достаточно подробно, мы убедились в альтернативности энергозапасающей и тепловыделяющей функций дыхания, которое образует либо АТФ, либо тепло. Теперь нам предстоит уже в более краткой форме познакомиться в двумя другими функциями дыхания, играющими роль в превращении веществ, а не энергии.
Метаболические процессы, жизненно необходимые для клетки, протекают с поглощением кислорода. При этом их итогом оказывается образование тех или иных полезных соединений. Одним из примеров такого рода может быть синтез стероидных гормонов в коре надпочечника. Исходным субстратом синтеза служит холестерин. Задача состоит в том, чтобы окислить в определенных местах эту молекулу и ввести в нее дополнительные атомы кислорода. Проблема решается с использованием сложной цепи реакций, часть из которых происходит в митохондриях, а часть - в эндоплазматической сети. Собственно реакции введения кислорода в холестериновый остов катализируются специальными ферментами оксигеназами, так называемыми цитохромами Р450. Чтобы связать кислород, цитохром Р450 должен быть восстановлен. Оксигенация холестерина сопровождается окислением цитохрома Р450. Регенерация восстановленного цитохрома Р450 происходит за счет окисления восстановленного никотинамидадениндинуклеотидфосфата особой дыхательной цепью, составленной из иных переносчиков, чем основная, сопряженная дыхательная цепь, также присутствующая в митохондриях коры надпочечников. Перенос электронов по цепи, завершающейся цитохромом Р450, не сопряжен с запасанием энергии (по-видимому, чтобы не отягощать такую важную функцию, как синтез гормона, превходящими обстоятельствами - наличием свободного АДФ).
Проблема доступности АДФ может быть особенно существенной, когда речь идет о крупномасштабных превращениях веществ, например образовании углеводов из жиров. Это событие требует потребления большого количества кислорода, поскольку углевод - более окисленное вещество, чем жир. Неудивительно, что совершению названного процесса сопутствует разобщение дыхания и фосфорилирования, что выводит дыхание из зависимости от процессов потребления АТФ.
Удалению из организма токсических соединений обычно предшествует их окисление кислородом с образованием продуктов, которые лучше растворимы в воде и потому могут быть быстрее выведены из организма через почки. Наиболее известный пример - детоксикация ксенобиотиков в печени цитохромом Р450. Этот процесс во многом подобен описанному в предыдущем разделе синтезу стероидных гормонов из холестерина. Здесь также происходит внедрение атома кислорода в органическое вещество (в данном случае чужеродное, откуда и название - ксенобиотик) под действием восстановленных цитохромов Р450, близких по структуре и механизму действия к цитохрому Р450 из коры надпочечников. При этом цитохром окисляется, чтобы затем быть восстановленным особой дыхательной цепью, локализованной в эндоплазматической сети. Цепь эта не сопряжена с генерацией протонного потенциала. Оксигенированный продукт затем подвергается либо дальнейшему окислению с участием того же цитохрома Р450 или его аналога, либо удалению из клетки.
В печени существует большое семейство родственных цитохромов Р450, специализированных на оксигенации самых разнообразных органических веществ, что позволяет обезвредить широкий круг ксенобиотиков.
Помимо ксенобиотиков дыхание участвует также в уборке молочной кислоты, конечного продукта бескислородного (анаэробного) метаболизма. При тяжелой и продолжительной физической работе в мышцах кончается кислород и единственным механизмом энергообеспечения становится анаэробный распад углеводов (гликолиз), завершающийся образованием молочной кислоты. Закисление ткани из-за накопления кислоты грозит денатурацией белков. Поэтому возникает проблема скорейшего удаления молочной кислоты после того, как работа уже выполнена.
Наши опыты показали, что при подкислении среды окисление молочной кислоты мышечными митохондриями направляется в обход первых пунктов энергетического сопряжения (NADН-KoQ-редуктазы и KoQO2-цитохром с-редуктазы, см. реакция (2)), что резко снижает количество АТФ, образованного при переносе электронов с NADН на кислород. Тем самым уборка молочной кислоты оказывается в меньшей зависимости от процессов потребления АТФ. Это должно быть особенно существенно в покоящейся мышце, где энергозатраты резко снижены по сравнению с состоянием физической работы. У дрожжей описан специальный фермент - цитохром b2 , переносящий электроны с молочной кислоты на цитохром с. Он локализован в межмембранном пространстве митохондрий и также шунтирует первые два пункта энергетического сопряжения.
Парадоксально, но одним из токсических продуктов, с которым сталкивается аэробная клетка, является сам кислород [5]. Вот почему клетка стремится поддерживать его концентрацию на минимальном уровне. Одним из механизмов, обеспечивающих эту функцию, оказывается опять-таки дыхание. Потребление кислорода дыхательными ферментами снижает количество кислорода в митохондриях и клетке в целом, тем самым предотвращая нежелательное действие кислорода как неспецифического окислителя многих клеточных компонентов. По логике, изложенной выше, можно было бы предположить, что также и эта особая функция дыхания должна обеспечиваться разобщенной или исходно не сопряженной дыхательной цепью. Исследования в целом подтвердили это предположение.
Например, бактерия, называющаяся "азотобактер", содержит нитрогеназу - фермент, восстанавливающий молекулярный азот в аммиак. Нитрогеназа очень чувствительна к повреждающему действию кислорода. Чтобы снизить концентрацию кислорода внутри клетки, азотобактер использует специальную дыхательную цепь, состоящую из особой несопряженной NADН-KoQ-редуктазы и KoQO2-оксидазы (цитохрома bd). Эффективность этой оксидазы вдвое ниже, чем цитохрома о, аналога цитохрома aa3 , также присутствующего в мембране азотобактера наряду с сопряженными NADН-KoQ-редуктазой и KoQO2-цитохром с-редуктазой. Как показали наши опыты, фосфорилирующая эффективность цепи, заканчивающейся цитохромом bd, впятеро ниже, чем другой цепи, завершающейся цитохромом о. При этом сродство к кислороду цитохрома bd существенно хуже, чем цитохрома о, поэтому при снижении уровня кислорода до безопасно малых его концентраций путь через цитохром bd просто выключается. Путь через цитохром bd получил название дыхательной защиты.
Нечто подобное существует также в митохондриях растений. Проблема защиты от кислорода у растений стоит особенно остро, так как они не только потребляют кислород, но также и образуют это вещество. Вопрос прежде всего в том, как предохранить от окисления молекулы ДНК митохондрий и хлоропластов, то есть органелл, где кислород может превращаться в супероксид и далее в перекись водорода и гидроксильный радикал, сильнейший природный окислитель [5]. Остается неясным, как справляются с защитой своей ДНК хлоропласты. Известно лишь, что они содержат большие количества одного из антиоксидантов - аскорбиновой кислоты. Что же касается митохондрий, то здесь, по-видимому, важную роль играет особая дыхательная цепь, состоящая из несопряженных NADН-KoQ-редуктазы и KoQ-оксидазы. В отличие от цепи дыхательной защиты у азотобактера эта цепь вовсе не запасает энергии. Ее работа приводит к поглощению кислорода безопасным способом, не связанным с риском образовать супероксид. В то же время, образование АТФ обеспечивается обычной (сопряженной) дыхательной цепью, локализованной в тех же митохондриях, а также фотосинтезом в хлоропластах и гликолизом в цитозоле растительной клетки.
Проблема дыхательной защиты животных клеток предположительно включает несопряженные пути в начале цепи (наподобие тех, что участвуют в уборке молочной кислоты) и особые механизмы разобщения основной цепи, а также выбраковку образующих супероксид митохондрий и клеток (апоптоз) (подробнее см. [5]). Изучая эту весьма сложную, глубоко эшелонированную защитную систему, невольно задаешься вопросом, почему все-таки ей не удается полностью предохранить наши клетки от повреждающего действия кислорода. В недавней работе японского биохимика Т. Озавы было показано, что у 97-летней старухи около 90% ДНК сердечных митохондрий безнадежно испорчены из-за ее окисления. Следует ли видеть в этом факте несовершенство живой системы или, как это ни парадоксально, здесь может быть свой биологический смысл?
Окисление ДНК активными формами кислорода представляет собой важнейший инструмент природного мутагенеза. Поддерживая частоту мутаций на определенном уровне, клетка могла бы обеспечить некий гарантированный уровень изменчивости, необходимой для эволюционного прогресса. Заманчиво предположить, что существует специальный механизм генерации супероксида, призванный обеспечивать оптимальный уровень мутагенеза. Альтернатива состоит в том, что окислительный мутагенез обусловлен тем супероксидом, который возникает при спонтанных химических реакциях окисления семихинонов и других одноэлектронных восстановителей кислорода. Однако в этом случае нам пришлось бы принять, что в таких важнейших вопросах, как стабильность и изменчивость генетического аппарата, клетка полагается на спонтанные процессы. Это противоречило бы принципу, что живые системы избегают самопроизвольных химических реакций, стремясь поставить их под контроль регулируемых катализаторов-ферментов.
Если верна возможность, что существует специальный ферментативный механизм дестабилизации генома, то, вероятно, выключение этого механизма могло бы стабилизировать жизнедеятельность организма, а стало быть, замедлить его старение и продлить жизнь. При этом, конечно же, снизились бы эволюционные потенции вида, но данное обстоятельство вряд ли актуально применительно к человеку. Homo sapiens давно уже не устраивает темп биологической эволюции. Если надо взлететь, мы строим самолет, а не ждем, пока у нас отрастут крылья. Когда нам не хватает расчетных способностей мозга, мы изобретаем компьютер, вместо того чтобы ждать, пока проэволюционирует наш мозг и все станут феноменами, умножающими в уме шестизначные числа.
1. Скулачев В.П. Соотношение окисления и фосфорилирования в дыхательной цепи. М.: Изд-во АН СССР, 1962. 156 с.
2. Скулачев В.П. Аккумуляция энергии в клетке. М.: Наука, 1969. 439 с.
3. Никольс Д.Дж. Биоэнергетика: Введение в хемиосмотическую теорию. М.: Мир, 1985. 190 с.
4. Скулачев В.П. Энергетика биологических мембран. М.: Наука, 1989. 564 с.
5. Скулачев В.П. Кислород в живой клетке: добро и зло // Соросовский Образовательный Журнал. 1996. N 3. С. 4-16.
6. Скулачев В.П. Законы биоэнергетики // Там же. 1997. N 1. С. 9-14.
7. Скулачев В.П. Эволюция биологических механизмов запасания энергии // Там же. N 5. С. 11-19.
* * *
Владимир Петрович Скулачев, действительный член Российской академии наук, президент Российского биохимического общества, директор Института физико-химической биологии им. А.Н. Белозерского МГУ. Лауреат Государственной премии СССР, премии им. А.Н. Баха Президиума АН СССР. Основатель отечественной школы энергетики биологических мембран. Автор фундаментальных работ по энергетике клетки, более 300 статей в российских и международных журналах, шести монографий и одного учебника.
Дизайн сайта разработан KN Graphics