|
В.Н. Анисимов |
"Молекулярные и физиологические механизмы старения" |
|
Назад |
Вперед |
1.6. Гены долголетия у мышей
|
Дело в том, что исчезла граница |
Применение методов генной инженерии позволило получить линии мышей с увеличенной продолжительностью жизни. Гомозиготные мыши с "выключенным" геном рецептора гормона роста (GHR-/-) живут значительно дольше, чем гетерозиготные (GHR+/-) животные или мыши дикого типа (GHR+/+) {Kopchick, Laron, 1999; Coschigano et al., 2000). У мышей GHR-/- наблюдается замедление роста, пропорциональная карликовость, уменьшение длины костей и содержания костных минералов, отсутствие рецептора гормона роста и ГР-связывающего белка, значительное уменьшение содержания в крови инсулинподобного фактора роста 1 и связывающего его белка-3, и увеличение в сыворотке крови концентрации ГР.
Карликовые мыши Эймса являются гомозиготными аутосомально-рецессивными мутантами, несущими единичные точечные мутации в гене Prophet pit-1 и живут на 50-64% дольше (самцы и самки соответственно), чем "дикий" тип (Brown-Borg et al., 1996; Brown-Borg, Rakoczy, 2000). Эта модель - один из первых примеров способности единичного гена значительно продлевать жизнь у млекопитающих- У этих мышей снижен уровень пролактина, тиреоидстимулирующего гормона (ТСГ), гормона роста (ГР), инсулин подобного фактора роста 1 (IGF-1) и инсулина в крови, повышена чувствительность к инсулину и понижена температура тела (Bartke et al., 2001). Как самцы, так и самки карликовых мышей бесплодны, у них выражена иммунодепрессия. Показано, что у этих мышей в печени снижен уровень глютатиона и аскорбиновой кислоты и увеличена активность каталазы по сравнению с контролем, что проявляется большей устойчивостью к окислительному стрессу (Mattison, 2000). Карликовые мыши Снелл (Snell) у которых имеется мутация в гене Pit1 (гипофизарно-специфичный транскрипционный фактор 1), также живут много дольше, чем нормальные мыши, что связывают с дефицитом у них продукции гормона роста (Flurkey et al., 2001).
У самок гетерозиготных мышей Igf1r+/- с частично нокаутированным геном рецептора IGF-1 наблюдали увеличение средней продолжительности жизни на 33 % по сравнению с самками дикого типа (р<0.001), тогда как у самцов - лишь на 16 %. У этих мышей не наблюдалось карликовости, основной обмен, температура тела, потребление корма, физическая активность и фертильность у них не отличались от контроля. Отмечена большая устойчивость этих мышей к окислительному стрессу по сравнению с контролем (Igf1r+/+) (Holzenberger et al., 2003).
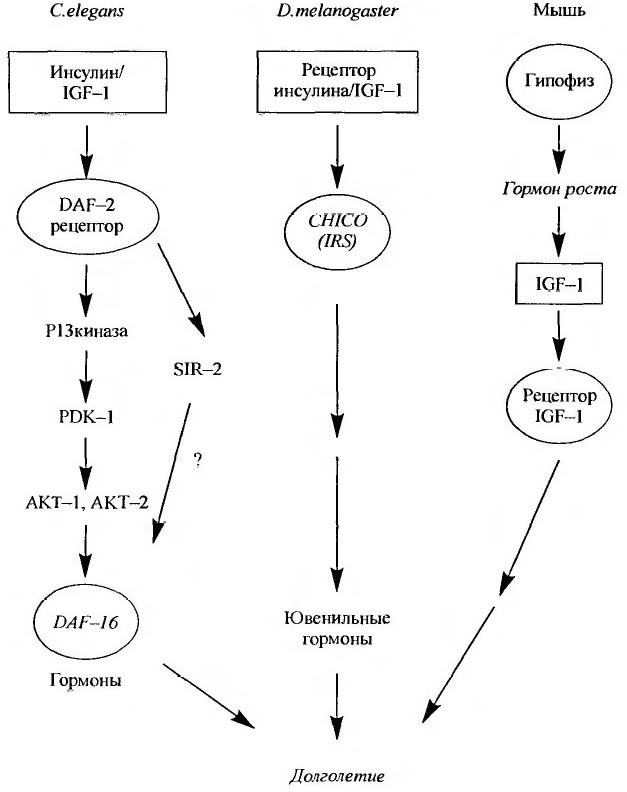
На рис. 4 представлены схемы эволюционно консервативных систем передачи сигнала инсулина у нематоды, плодовых мух и млекопитающих.
Мутация адапторного гена, кодирующего белок p66shc у мышей, привела к развитию устойчивости к вызванному паракватом окислительному стрессу, индуцирующему продукцию анионов супероксида, и увеличению продолжительности жизни животных на 30% (Migliaccio et ah, 1999). Этот ген, кодирующий белок p66shc, фосфорилируется по тирозину в ответ на активацию рецепторов фактора роста и образует стабильные комплексы с Grb2 - адапторным белком для ras-зависимого SOS-фактора. Белок p66shc представляет собой вариант соединенных белков p52shc и р46shc и является цитоплазматическим сигнальным трансдуктором в процессе передачи митогенных сигналов от активированных рецепторов к Ras. Предполагается, что p66shc вовлечен в феноптоз, то есть запрограммированную гибель организма, обусловленную массовым апоптозом в жизненно важных органах в результате воздействия активных форм кислорода (Skulachev, 2000).

Рис. 4 Схема передачи сигнала инсулина у нематоды, плодовых мух и млекопитающих.
Трансгенные мыши со встроенным геном
![]() -MUPA, который индуцирует в головном мозге продукцию мРНК, кодирующую урокиназу активатора плазминогена, потребляют на 20% меньше корма и живут на 20% дольше мышей дикого типа. Эти мыши имели значительно сниженную температуру тела и уменьшение уровня котикостерона в плазме в старческом возрасте (Miskin et al., 1999).
-MUPA, который индуцирует в головном мозге продукцию мРНК, кодирующую урокиназу активатора плазминогена, потребляют на 20% меньше корма и живут на 20% дольше мышей дикого типа. Эти мыши имели значительно сниженную температуру тела и уменьшение уровня котикостерона в плазме в старческом возрасте (Miskin et al., 1999).
Таким образом, как у нематод и дрозофил, так и у мышей выявлено достаточно большое число генов, которые ассоциированы с долголетием (табл. 6).
Таблица 6
Генетические модификации, увеличивающие продолжительность жизни мышей
| Мутация, ген | Продукт гена, функция | Тип мутации | Изменение продолжительности жизни, % |
Авторы |
| Ргор-1 | Гипофизарно-специфичный транскрнпцнонный фактор |
Аутосомально- рецессивный |
+65 (самки) +50 (самцы) |
Brown-Borg et al., 1996 |
| Pit-1 | Гипофизарно-специфичный транскрипционный фактор 1 | » | +45 | Flurkey et al., 2002 |
| Grh+ | Рецептор гормона роста | Нокаут | +25 | Coschigano et al., 2000 |
| Igf1r+/- | Рецептор ICF-1 | Частичный нокаут | +33 (самки) +16 (самцы) |
Holzenberger et al., 2003 |
| FIRKO | Рецептор инсулина в адипоцитах |
Нокаут | +16 | Blucbcr et al., 2003 |
| p66shc-/- | Адапторный белок окислительного стресса | » | +30 | Migliaccio et al., 1999 |
| Trd | Тиоредоксин; восстанавливает окисленные группы в белке |
Суперэкспрессия | +30 | Mitsui et al., 2002 |
| MGTM | Метилгуонин-метилтрансфераза; репарация ДНК, алкилированной по О6-гуанину | » | Увеличивает выживаемость |
Qin el al., 2000 |
|
|
Активатор плазминогена | » | +20 | Miskin et al., 1999 |
|
Назад |
Вперед |
Дизайн сайта разработан KN Graphics