Jacob J. Schmidt and Carlo D. Montemagno cdm@seas.ucla.edu
Drug Discovery Today 2002, 7:500-503
Адаптация и перевод (c) Immortality team.
Быстрая миниатюризация в полупроводниковой промышленности привела к разработке быстрых и эффективных вычислительных устройств, которые приближают время революционных перемен в диагностике и терапии. Литографическая методика электрических соединений, применяемая при сборке микропроцессоров и модулей памяти, позволяет создавать устройства, известные как микро- и наноэлектромеханические системы (MEMS и NEMS).
В настоящее время размеры MEMS варьируют от одного до сотен микрометров, а размеры NEMS лежат в области шкалы нанометров. Концепция применения контролируемых извне устройств MEMS для манипуляций над биологической тканью на клеточном и субклеточном уровнях давно притягивает к себе интерес крупнейших ученых в области медицины и нанотехнологии. Первые работы в этой области показали возможность обнаружения нарушений структуры ДНК [1] и количественного обнаружения антигенов [2] с использованием консольной системы, а также механического захвата и манипулирования отдельными клетками.
Привлекательность применения таких механизмов для анализа и манипуляций над биологическими системами in vitro и in vivo очевидны: малая инвазивность, экономия реактивов, высокая чувствительность и специфичность, возможность локальной диагностики и терапии. Хотя нынешние технологии еще не позволяют определять фемтомолярные концентрации в условиях лабораторий, вероятно, что имплантируемые или автономно циркулирующие механизмы смогут измерять минутную концентрацию биологических веществ и лекарств в их натуральном окружении и «сообщать» о результатах измерения внешним устройствам.
Поскольку BioMEMS предполагают взаимодействие с биологической средой, то крайне важным аспектов является биологический (органический) компонент устройства. Это может быть нуклеиновая кислота, антитела, рецепторы. Эти молекулы сохраняют свои биологические свойства, будучи прикрепленными к искусственному микро- или наноносителю (чаще всего – тиольные группы - золото), их взаимодействие и функции возможно отслеживать механически (деформация консолей), электрически (изменения тока или напряжения в сенсорах) или оптически (поверхностный плазмонный резонанс). Биологические составляющие нанокриттеров могут быть в размерах менее нанометра, таким образом, общий размер нанокриттера ограничен размером неорганического носителя, в настоящее время это 100 нм – 1 мкм.
Еще одной проблемой является стоимость наноустройств, вдобавок ко всему не решена проблема трения, что приводит быстрому износу неорганической части нанокриттера. Наконец, не решена проблема энергоснабжения, что крайне ограничивает автономность подобных устройств.
Открытие так называемых механических белков привело к появлению первого поколения гибридных нанокриттеров длиной менее 50 нм, снабжаемых оптической или химической энергией и способных выполнять простейшие действия в организме.В качестве механичесого белка-мотора используется молекула F1-АТФазы. F1-АТФаза является компонентом F0F1-АТФазы, белка, преобразующего электроосмотическую энергию градиента протонов в химическую энергию связей АТФ у бактерий, растений и животных. Компоненты F0 и F1 механически связаны и представляют собой статор (F0) 12 нм в диаметре и ротор (F1) 3 нм в диаметре, который вращается при потреблении АТФ.
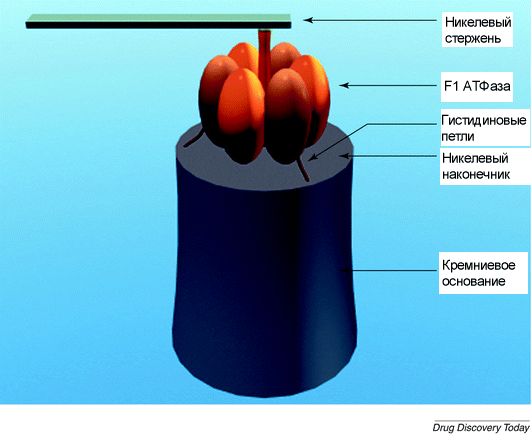
На рис.1 схематически изображен нанокриттер на основе ротора F1, созданный в нашей лаборатории. F1-АТФаза присоединена к неорганическому субстрату и способна вращать никелевый стержень, прикрепленный к ротору [4]. «Двигатель» был изменен с помощью генной инженерии с целью получения гистидиновых петель на одной из его сторон, с помощью которых осуществлялось крепление к никелевой «шапочке» на неорганической основе. Никелевые стержни изготавливались при помощи электронно-лучевой литографии, полученные размеры 75х15х750 нм. Нанокриттер производил 8 оборотов в секунду. В других работах указывается на возможность достижения 130 и более оборотов в секунду с минимальной нагрузкой [5,6] .

Рис.1 Гибридное устройство, работающее на энергии F1-АТФазы.
Кроме АТФазы, в качестве биологических моторов могут использоваться и другие молекулы – например, кинезин. Используя энергию АТФ, молекула белка совершает однонаправленные поступательные движения вдоль 25 нм микротрубочки. В природе этот белок лежит в основе внутриклеточного транспорта, обеспечивает движение клеточных цилий (ресничек), а также участвует в процессах самообновления клетки.
Тубулином не ограничивается выбор механических белков, которые можно использовать при создании наноустройств. Обобщая, можно сказать, что подобные белки невелики (десятки наноматров), способны обеспечивать относительно высокую скорость (более 50 мкм/сек) и подвижны по своей природе, используя в качестве топлива энергию АТФ.
Ко всему прочему, известно более сотни различных механобелков прокариотов, растений и животных. Каждый из этих белков адаптирован к специфическим задачам за миллионы лет эволюции, и при разработке нанокриттеров следует это учитывать. Экономические преимущества синтеза таких белков очевидны – ген, отвечающий за их синтез, можно встроить в геном бактерий, и получать промышленные объемы механопротеинов. В лабораторных условиях отдача составляет 1016 механобелков за три дня, более 1014 за сутки. Получаемый продукт готов к использованию и гибридизации с органическими или неорганическими компонентами, с получением нового продукта, качествами которого не обладает ни один составляющий по одиночке.
В конечном счете, возможным станет введение наноустройств в организм с целью выполнения конкретной задачи, – например, распознавание и деструкция раковых клеток. Нынешние разработки, направленные на целевую доставку лекарственных средств к месту их назначения также могут быть реализованы с помощью нанокриттеров. Имея наноразмеры, эти устройства могут работать даже внутриклеточно, они могут вводится в кровоток и поступать в клетки пассивно или же активно, используя в качестве двигателя механобелки. Взаимодействие «лиганд-рецептор» или «антитело-антиген» будет запускать реакцию высвобождения лекарственного средства из носителя в среду, окружающую мишень, или непосредственно в мишень. Содержимым носителя может быть практически любое химическое вещество или еще меньшие наноустройства, которые смогут регулировать работу внутриклеточных структур, «ремонтировать» ДНК и выполнять другие функции.
Не кажется ли это фантастикой? Возможность существует в ближайших десятилетиях. Многие из компонентов наноустройств разработаны и существуют в наши дни. Размеры транзисторов приближаются десяткам нанометров, их и другие полупроводники, которые можно организовать в компьютер, способный выполнять расчеты, и создать наноробота-гибрида, который будет передвигаться и получать энергию с помощью механобелков..
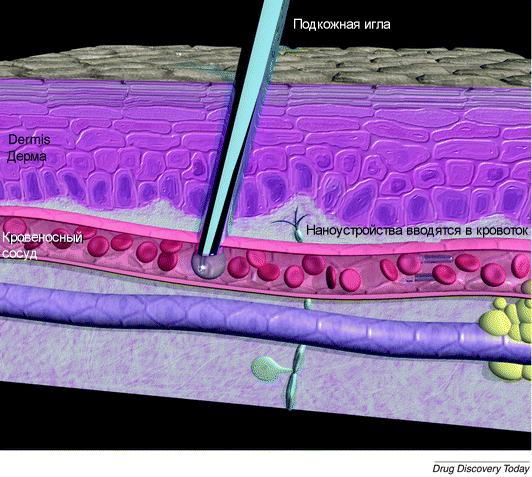
Рис. 2. Механическое лекарство. Нанороботы вводятся в кровоток. Как только они находят свою цель, высвобождается химическое вещество или робот выполняет определенную программу.
Биотехнология – это зарождающаяся наука, своеобразный сплав физики, химии, биологии и инженерных наук, измеряемых в нанометрах. До последнего времени оперирование такими размерами было уделом не-биологических наук, изучающих процессы в вакууме или при низких температурах. Используя Жизнь, природа создала эффективное производство биологических «наномашин» в организме, которые работают при комнатной температуре в водной среде. Мы еще не полностью понимаем их устройство и механизм действия, но уже сегодня имеется возможность создавать простейшие искусственные нанороботы, которые вскоре смогут работать автономно, двигаться и взаимодействовать с окружающей их средой на пользу организма..
1. Fritz J. et al. (2000) Translating biomolecular recognition into nanomechanics. Science, 288:316-318.
2. Wu G. et al. (2001) Bioassay of prostate-specific antigen (PSA) using microcantilevers. Nat. Biotechnol., 19:856-860.
3. Soong R.K. et al. (2000) Powering an inorganic nanodevice with a biomolecular motor. Science, 290:1555-1558.
4. Yasuda R. et al. (1998) F1-ATPase is a highly efficient molecular motor that rotates with discrete 120 degree steps. Cell, 93:1117-1124.
5. Yasuda R. et al. (2001) Resolution of distinct rotational substeps by submillisecond kinetic analysis of F1-ATPase. Nature, 410:898-904.
6. Kacher C.M. et al. (2000) Imaging microtubules and kinesin decorated microtubules using tapping mode atomic force microscopy in fluids. Eur. Biophys. J., 28:611-620.
7. Hess H. et al. (2001) Light-controlled molecular shuttles made from motor proteins carrying cargo on engineered surfaces. Nanoletters, 1:235-239.
8. Limberis L. and Stewart R.J. (2000) Toward kinesin-powered microdevices. Nanotechnology, 11:47-51.
9. Benson D.E. et al. (2001) Design of bioelectronic interfaces by exploiting hinge-bending motions in proteins. Science, 293:1641-1644.
10. Harder P. et al. (1998) Molecular conformation in oligo(ethylene glycol)-terminated self-assembled monolayers on gold and silver surfaces determines their ability to resist protein adsorption. J. Phys. Chem. B, 102:426-436.
11. Nakagaki T. et al. (2000) Maze-solving by an amoeboid organism. Nature, 407:470.
12. Tsunoda S.P. et al. (2001) Large conformational changes of the ( subunit in the bacterial F1F0 ATP synthase provide a ratchet action to regulate this rotary motor enzyme. Proc. Natl. Acad. Sci. U. S. A., 98:6560-6564.
13. Karcher R.L. et al. (2001) Cell cycle regulation of myosin-V by calcium/calmodulin-dependent protein kinase II. Science, 293:1317-1320.
Дизайн сайта разработан KN Graphics