Гарвардский Институт Стволовой Клетки был основан в апреле 2004 года. Он ведет широкие исследования в области стволовых клеток. Задача института состоит в том, чтобы выдающиеся успехи, достигнутые в лабораториях в области стволовых клеток сделать доступными в клиниках.
Новое исследование, которое проводят Kevin Eggan, Douglas Melton и коллеги, вселяет надежду, что в будущем может быть возможным получение эмбриональных стволовых клеток без использования человеческих эмбрионов. Исследователи из Harvard Stem Cell Institute собираются написать статью в журнал Science, номер которого выйдет 26 августа, о том, что можно получить клетки со свойствами эмбриональных стволовых клеток путем слияния двух клеток. Однако, исследователи предупреждают, что на этом пути существует еще много препятствий.
В настоящее время исследование стволовых клеток порождает много споров, поскольку для этого необходимо разрушать человеческие эмбрионы или использовать неоплодотворенные женские яйцеклетки. При терапевтическом клонировании ядро клетки взрослого человека (например, клетки кожи) вводится в неоплодотворенную яйцеклетку, у которой собственный генетический материал был удален. Яйцеклетка перепрограммирует ядро клетки кожи в эмбриональное состояние, давая начало развитию раннего эмбриона без необходимости оплодотворения. Как недавно продемонстрировали исследователи из Кореи, получающиеся эмбрионы могут быть использованы для получения эмбриональных стволовых клеток, которые генетически идентичны клеткам кожи донора. Но данный метод является технически трудным, используются эмбрионы и, поскольку он требует донорских человеческих яйцеклеток, то маловероятно, что этот метод когда-нибудь сможет стать широко распространенным в клиниках.
Исследователи HSCI предприняли абсолютно другой подход, в котором производится слияние целой клетки кожи с существующей эмбриональной стволовой клеткой. В результате получается гибридная клетка с двумя наборами генетического материала. Используя усовершенствованную технологию 'DNA chip', команда ученых из Гарварда смогла показать, что клеточное слияние позволило перепрограммировать тысячи генов клетки кожи в эмбриональное состояние. Еще более поразительно то, что у полученных гибридов, как обнаружили авторы, вернулись свойства эмбриональных стволовых клеток, включая способность к дифференцировке во множество типов взрослых клеток.
Оригинальный текст этой статьи Вы можете найти на сайте Harvard Stem Cell Institute.
Chad A. Cowan, Jocelyn Atienza, Douglas A. Melton, Kevin Eggan*
Мы изучили использование эмбриональных стволовых клеток как альтернативу ооцитам для перепрограммирования соматического ядра человека. Человеческие эмбриональные стволовые (hES) клетки сливались с человеческими фибробластами, в результате чего получались гибридные клетки, стабильно сохраняющие тетраплоидную ДНК и имеющие морфологию, темп роста и характеристики антигенной экспрессии hES клеток. Дифференцировка гибридных клеток in vitro и in vivo приводила к получению типов клеток каждого эмбрионального зародышевого слоя. Широкий геномный анализ транскрипционной активности, активности репортерного гена, аллель специфической генной экспрессии и метилирования ДНК показали, что соматический геном был перепрограммирован в эмбриональное состояние. Эти результаты подтверждают, что hES клетки могут перепрограммировать транскрипционное состояние соматического ядра и предоставляют систему для изучения лежащих в основе этого механизмов.
Поколение эмбриональных стволовых (ES) клеточных линий и клонированные животные путем переноса ядра соматической клетки показали, что цитоплазма ооцита может перепрограммировать геном соматической клетки в эмбриональное состояние (1, 2). Значительный интерес сейчас представляет вопрос, как происходит перепрограммирование, поскольку понимание механизма этого процесса может позволить непосредственно конвертировать взрослые соматические клетки в человеческие эмбриональные стволовые (hES) клетки и таким образом получить клеточные линии для изучения и использования их в лечении человеческой болезни (3-7).
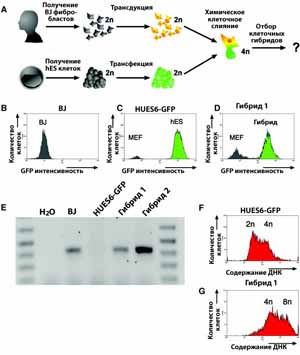
Основываясь на мышиных ES клетках (8, 9), мы пришли к заключению, что hES клетки могут обеспечить альтернативный источник материала для перепрограммирования человеческого соматического ядра. Для изучения этого мы использовали полиэтиленгликоль (PEG) для сливания hES клеток с человеческими BJ фибробластами (рис. 1А). Поскольку по своей природе сливание клеток малоэффективно, мы трансфецировали hES клетки и трансдуцировали BJ фибробласты с помощью ретровируса с независимыми устойчивыми к медикаментам маркерами для отбора любых гибридов, которые могут быть получены (рис. 1А). В результате устойчивые к гидромицину, зеленый флюоресцирующий белок (GFP)-положительные hES клетки (HUES6-GFP) и устойчивые к пуромицину BJ фибробласты были смешаны в присутствии PEG и подвергнуты двойному отбору в условиях, используемых для поддержания hES клеток (10). После 10 дней отбора, 12 ( 3, Т=3) отдельных колоний устойчивых клеток были исследованы. Две типичные колонии были отобраны, размножены и ферментативно перенесены несколько раз перед проведением анализа.
Для подтверждения того, что эти устойчивые к медикаментам клетки прошли через слияние, мы оценили генетические маркеры, имеющиеся у обоих партнеров. Анализ с помощью флюоресцентно-активированной сортировки клеток (FACS) показал, что сходные с HUES6-GFP клетки (рис. 1C), устойчивые клетки экспрессировали GFP (рис. 1D). Используя полимеразную цепную реакцию (PCR), мы определили, что устойчивые к медикаментам клетки также содержали вирусный вектор, введенный в BJ фибробласты (рис. 1E). Согласуется с утверждением, что эти клетки прошли слияние, и тот факт, что они содержали двойное количество родительской ДНК, которая содержалась в HUES6-GFP (рис. 1F, 1G) клетках. Хромосомный анализ одной из гибридных клеточных линий показал, что клетки содержат преимущественно 92 хромосомы (рис. S1A). Эти результаты показывают, что после слияния hES и соматической клетки были получены стабильные клеточные гибриды, которые содержали как хромосомы соматической клетки, так и хромосомы hES в одном ядре (рис. S1B).
Рис. 1. Поколение стабильных гибридных клеток, полученных путем слияния hES клеток и человеческих соматических клеток. Существующие соматические и hES клеточные линии были стабильно трансдуцированы или трансфецированы с независимыми устойчивыми к медикаментам маркерами и подвергнуты слиянию в присутствии PEG. После слияния клетки растили в стандартных условиях для поддержания hES клеток в присутствии антибиотиков для отбора клеточных гибридов (A). FACS анализ GFP экспрессии в BJ фибробластах (В), HUES6-GFP клетках (C), и гибридных клетках (D). PCR амплификация специфических последовательностей ДНК к ретровирусу, который использовался при трансдукции соматических BJ фибробластов (Е). FACS клеток HUES6-GFP (F) и гибридных клеток (G), окрашенных иодидом пропидия..
Когда были получены эти стабильные клеточные гибриды, мы задались вопросом, происходит ли перепрограммирование соматического генома в эмбриональное состояние. Если это так, то гибридные клетки должны иметь фенотип, сходный с родительскими hES клетками. Гибридные клетки росли тесно, phase bright кластерами, были похожи по внешнему виду на клетки hES и отличались от веретено-образных фибробластов (11) (рис. 2A). Анализ содержания ДНК (рис. 1G) гибридных клеток показывает, что характеристики клеточного цикла были сходными с hES клетками (рис. 1F). Мы переносили линии гибридных клеток более 50 раз (9120 удвоений популяции), демонстрируя неуменьшающиеся ростовые характеристики hES клеток. Кроме того, гибридные клетки экспрессировали несколько маркеров, характеризующих hES клетки, включая транскрипционный фактор OCT4 (рис. 2В), щелочную фосфотазную активность (рис. S2A), теломеразную активность (рис. S3 A), и специфичную для эмбрионов активность антигенов SSEA4 (рис. S2B), TRA1-61 (рис. S2C), и TRA1-80 (рис. S2D) с концентрациями, близкими к тем, что найдены у клеток HUES6-GFP (10-16). В противоположность этому, соматические BJ клетки не имели этих характеристик.
Рис. 2. Гибридные клетки могут приобретать фенотип hES клеток. Устойчивые к медикаментам гибридные клетки росли тесно, phase bright клеточными кластерами с морфологией, идентичной таковой у hES клеток (А). HES клетки и гибридные клетки экспрессировали GFP (зеленые) и транскрипционный фактор OCT4 (красный), тогда как GFP-отрицательные BJ фибробласты и мышиные эмбриональные фибробласты этого не делали (B). Иммунологическое окрашивание тератом, полученных от гибридных клеток, показывает присутствие различных типов клеток, включая нейроны, окружающие ES производные волосяные фолликулы, которые экспрессировали нейроспецифичный табулин (Tuj1, красный) (обратите внимание на флюоресценцию волос, зеленый) (C), скелетную мышцу, экспрессирующую тяжелую цепочку миозина (MF20, красный) (D), и кишечную эндодерму, экспрессирующую зародышевый белок альфа (AFP, красный) (E). Масштаб 50 мкм.
Для определения, проявляют ли гибридные клетки плюрипотентность
hES клеток, мы оценили их способность к дифференцировке in vitro и in vivo
(10,11,17). Когда работа с культурой была приостановлена, линии гибридных клеток
образовывали эмбриоидные тела (EBs), и тератомы после введения голым мышам.
Иммунологическое окрашивание показало, что тератома (рис. 2, C-E) и EBs (рис.
S3, B-D) содержали клетки, экспрессирующие
![]() III-тубулин (нейродерма) (18),
мышечно-специфичный миозин (мезодерма) (19), и зародышевый белок альфа
(эндодерма) (20).
III-тубулин (нейродерма) (18),
мышечно-специфичный миозин (мезодерма) (19), и зародышевый белок альфа
(эндодерма) (20).
Рис. 3. Транскрипционное и эпигенетическое перепрограммирование соматического генома в гибридных клетках. Для тестирования реактивации эмбриональных генов из соматических хромосом, мы использовали Rex1-GFP репортер, который активен после трансфекции в hES клетки (А), но молчит после трансфекции в BJ фибробласты (В). Когда трансгенные фибробласты (В) сливались с нетрансгенными HUES6 hES клетками (С), полученные гибриды клеток экспрессировали GFP (D). Масштаб (A-D) 50 мкм. Для изучения была ли реактивация транскрипции эмбриональных генов в соматических хромосомах, мы провели ПЦР с обратной транскрипцией с праймерами, специфичными к гену TDGF1 (E). Анализ метилирования ДНК у промотора OCT4 показал, что эпигенетическое состояние гибридных клеток также было перепрограммировано (F). Для определения того, подавляется ли транскрипция генов, экспрессирующихся только в соматических клетках после клеточного слияния, мы провели широкое транскрипционное профилирование по геному (G-I). Гены со значением экспрессии в 2 раза выше в BJ клетках по сравнению с hES клетками (сомато-специфичные гены) или в два раза ниже в BJ клетках по сравнению с hES клетками (hES-специфичные гены) были отмечены и их экспрессия была проанализирована в гибридных клетках. Eisengram показал ''heat plots'' генных образцов (red, on; blue, off) (G) и Venn диаграммы (H и I), представляющие результаты сравнения пар из транскрипционных профилей трех типов клеток, продемонстрировали, что транскрипционная программа соматической программы "замолкает" в гибридных клетках, тогда как эмбриональная программа перепрограммируется.
Для изучения была ли реактивация транскрипции эмбриональных генов в соматических хромосомах, мы использовали трансгенный репортер, в котором GFP экспрессия зависела от промоторных элементов из мышиного гена Rex-1 (21). Rex-1 экспрессируется в ES клетках [а также преимплантационные мышиные эмбрионы и сперматоциты (21)]. Этот репортер был активен после трансфекции в HUES6 hES клетки (рис. 3А), но неактивен после введения в BJ фибробласты (рис. 3В) (21). Когда BJ клетки, несущие репортер, слились с GFP-отрицательными HUES6 hES клетками (рис. 3C), полученные гибриды (рис. 3D) экспрессировали GFP концентрации, близкие к клеткам HUES6, трансфецированным с тем же репортером.
Мы показали, что эндогенные гены, регулирующие формирование плюрипотентности, транскрибировались в соматическом геноме, благодаря проведению анализа аллель специфичной экспрессии. Продукт гена CRIPTO/TDGF1 функционировал как компонент NODAL сигнального пути и экспрессировался в hES клетках, но не в BJ фибробластах (рис. 3E, таблица S4). Единичный нуклеотидный полиморфизм, специфичный для BJ клеток, был идентифицирован в 3' нетранслируемой области CRIPTO/TDGF1 транскрипта (рис. S3E) и проверен в гибридных клетках. Три из девяти кДНК, выделенных из гибридных клеток, содержали BJ специфичный полиморфизм, показывая, что соматические аллели этого гена были активированы после слияния клеток (рис. S3F).
Для определения того, сосуществуют ли соматические и эмбриональные состояния в гибридных клетках, или эмбриональная программа доминирует, мы провели широкое геномное транскрипционное профилирование. Колебание в транскрипционных профилях между репликацией и различными клеточными линиями было посчитано как корреляционный коэффициент Пирсона (PCC) и оценивался более чем в 54 675 наборах проб (таблица S1). Коэффициенты Пирсона показывают, что транскрипционные профили для BJ фибробластов и HUES6-GFP клеток были очень разными [PCC = 0.780, в диапазоне от 0.768 до 0.789, n = 9], тогда как транскрипционные профили HUES6-GFP ES клеток и двух независимых линий гибридных клеток мало различались (HUES6 против гибрида 1, PCC = 0.985, в диапазоне от 0.979 до 0.989, n = 9; HUES6 против гибрида 2, PCC = 0.984, в диапазоне от 0.978 до 0.989, n = 9). Действительно, различия между HUES6-GFP ES клеточной линией и двумя линиями гибридных клеток были меньше, чем мы и другие авторы наблюдали между независимо получаемыми hES клеточными линиями (HSF-6B против HSF-1B, PCC = 0.978) (таблица S1) (22).
Попарное сравнение мужских BJ клеток и женских HUES6-GFP hES клеток показало, что 3867транскриптов имели значения экспрессии как минимум в двое выше в BJ фибробластах. Только 12 из этих сомато-специфичных транскриптов удерживали свой высокий уровень экспрессии в клеточных гибридах (рис. 3, G и H) (таблица S2). Пять из этих двенадцати были связаны с Y хромосомой, наводя на мысль, что их значения экспрессии отражают получение Y хромосомы от BJ клеток, а не ошибку в перепрограммировании (рис. 3G и таблица S2). Фактически, экспрессия генов в гибридных клетках, связанных с Y хромосомой, отмечалась в сходных количествах в мужских клеточных линиях hES (22, 23). Аналогично, только 20 из 2521 hES специфических транскриптов (в два или три раза выше в hES, чем BJ) в гибридах имели количества ниже, чем в hES клетках (рис. 3, G и I и таблица S3), и большинство из них имели значения более близкие к таковым в hES клетках, чем в BJ клетках. Особенно нужно отметить, что плюрипотентные гены, включая OCT4, NANOG, TDGF1, и REX1 (24-27), имели экспрессию удивительно близкую по концентрации в hES и гибридных клетках (таблица S4). В общем, эти данные показывают, что после формирования стабильных гибридов клеток, сомато-специфичные гены замолкают в целом геноме, тогда как эмбриональная программа транскипции становится доминирующей. Действительно, по результатам анализа можно заключить одно, что >99% проанализированных транскриптов было перепрограммировано.
Далее мы исследовали, была ли перепрограммирована эпигенетическая информация, лежащая в основе транскрипции плюрипотентных генов, путем анализа статуса дифференцированно метилированной области в промоторе гена OCT4 (28). Согласуясь с предыдущими результатами (28), секвенирование бисульфит модифицированной ДНК показало, что CpG динуклеотиды в этой области были в основном метилированны в соматических BJ клетках и неметилированы в hES клеках (рис. 3F). Важно, что при анализе ДНК гибридных клеток эта область не была метилирована и не отличалась по эпигенетическому состоянию от hES клеток (рис. 3F).
Наконец, мы создали стабильные клеточные гибриды путем слияния другой клеточной линии hES, H9 (10) с клетками тазовой кости TE76.T, демонстрируя, что возможность hES клеток к перепрограммированию соматического генома не ограничена конкретной линией hES клеток или соматической линией.
В заключение, эти открытия показывают, что hES клетки имеют возможность перепрограммировать хромосомы взрослых соматических клеток после слияния. HES клетки могут, следовательно, стать полезным дополнением человеческим ооцитам для биохимических и генетических исследовательских целей в понимании того, как перепрограммировать дифференцированные клетки в эмбриональное состояние и тем самым увеличить их потенциал. Со временем этот подход может привести к альтернативному пути создания генетически подготовленных hES линий клеток для использования в исследовании и лечении болезни человека. Однако, остается значительный технический барьер, прежде чем hES клетки можно будет использовать для терапевтических целей: точнее, удаление хромосом ES клетки или перед или после клеточного слияния (18). Если удаление ядра hES клетки может быть выполнено без потери перепрограммирующей активности и/или если это исследование слияния приведет к пониманию факторов, необходимых для перепрограммирования, эти подходы могут обойти некоторые логические и социальные беспокойства относительно переноса ядра соматической клетки в человеческие ооциты.
1. K. Hochedlinger, R. Jaenisch, Nature 415, 1035 (2002).
2. I. Wilmut, A. E. Schnieke, J. McWhir, A. J. Kind, K. H. Campbell, Nature 385, 810 (1997).
3. K. Hochedlinger, R. Jaenisch, N. Engl. J. Med. 349, 275 (2003).
4. G. Q. Daley, Curr. Opin. Genet. Dev. 12, 607 (2002).
5. J. B. Gurdon, J. A. Byrne, S. Simonsson, Proc. Natl. Acad. Sci. U.S.A. 30, 11819 (2003).
6. W. M. Rideout III, K. Eggan, R. Jaenisch, Science 293, 1093 (2001).
7. W. S. Hwang et al., Science 308, 1777 (2005); published online 19 May 2005 (10.1126/science.1112286).
8. M. Tada, Y. Takahama, K. Abe, N. Nakatsuji, T. Tada, Curr. Biol. 11, 1553 (2001).
9. J. T. Do, H. R. Scholer, Stem Cells 22, 941 (2004).
10. С A. Cowan et al., N. Engl. J. Med. 350, 1353 (2004).
11. J. A. Thomson et al., Science 282, 1145 (1998).
12. A. H. Brivanlou et al., Science 300, 913 (2003).
13. P. W. Andrews, G. Banting, I. Damjanov, D. Arnaud, P. Avner, Hybridoma 3, 347 (1984).
14. R. Kannagi et al., EMBO J. 2, 2355 (1983).
15. L. H. Shevinsky, B. B. Knowles, I. Damjanov, D. Solter, Cell 3, 697 (1982).
16. J. Nichols et al., Cell 95, 379 (1998).
17. J. Itskovitz-Eldor et al., Mol. Med. 6, 88 (2000).
18. S. S. Easter, L. S. Ross, A. Frankfurter,J. Neurosci. 13, 285 (1993).
19. D. Bader, T. Masaki, D. A. Fischman,J. Cell Biol. 95, 763 (1982).
20. D. J. MacDonald, A. M. Kelly, Clin. Chim. Acta 87, 367 (1978).
21. R. Eiges et al., Curr. Biol. 11, 514 (2001).
22. M. J. Abeyta et al., Hum. Mol. Genet. 13, 601 (2004).
23. B. Bhattacharya et al., Blood 103, 2956 (2004).
24. M. Richards, S. P. Tan, J. H. Tan, W. K. Chan, A. Bongso, Stem Cells 22, 51 (2004).
25. N. Sato, L. Meijer, L. Skaltsounis, P. Greengard, A. H. Brivanlou, Nat. Med. 10, 55 (2004).
26. I. Chambers et al., Cell 113, 643 (2003).
27. H. Zaehres et al., Stem Cells 23, 299 (2005).
28. P. Deb-Rinker, A. Ly, A. Jezierski, M. Sikorska, P. R. Walker,/ ВЫ. Chem. 280, 6257 (2005).
29. Мы благодарим J. Zucker, B. Haas и H. Chipperfield за техническую поддержку; N. Benvenisty и R. Eiges за Rex1-GFP репортерную конструкцию, Rex1-GFP трансгенные BJ фибробласты, и за критическое прочтение этого материала A. Meissner и R. Jaenisch за лентивирусный вектор; и A. Aggarwal и С Morton за работу с кариотипом. Эта работа частично поддерживалась Naomi Berrie Diabetes Center и Rx Foundation и была рецензирована и одобрена комитетами исследования животных, стволовых клеток и людей Факультета Искусства и Науки Гарвардского Университета.
Рис. S1. Гибридные клетки тетраплоидны. Хромосомный набор (А) демонстрирует, что гибридные клетки имеют 92 хромосомы в одном ядре (В). Масштаб 3 мкм.
Рис. S2. Экспрессия эмбриональных антигенов в гибридных клетках. GFP положительные (зеленые) hES клетки и гибридные клетки демонстрируют активность щелочной фосфотазы (AP, красный) (A), SSEA-4 (красный) (B), TRA1-60 (красный) (C) и TRA1-81 (красный) (D), в то время как GFP отрицательные BJ фибробласты и эмбриональные фибробласты мыши нет. Масштаб 50 мкм.
Рис. S3. Гибридные клетки имеют фенотип hES клеток и экспрессируют эмбриональные гены. Анализ активности теломеразы при TRAP оценке показал, что подобно hES клеткам, гибридные клетки экспрессируют высокие уровни этого энзима (А). Иммунологическое окрашивание эмбриональных тел, полученных из гибридных клеток, показывает присутствие различных типов клеток, включая нейроны, которые экспрессируют нейроспецифический тубулин (Tuj1, красный) (B), скелетную мышцу, экспрессирующую тяжелую цепочку (MF20, красный) (C) и кишечный эндодерм, экспрессирующий зародышевый белок альфа (AFP, красный) (D). Последовательность геномной ДНК из BJ фибробластов и HUES6 клеток показали, что фибробласты содержат уникальный одиночный нуклеотидный полиморфизм, который не присутствует в HUES6 клеточном геноме (Е). Последовательность ДНК из гибридных клеток (F) показывает, что гибридные клетки содержат TDGF1 транскрипты, которые изначально были в соматических хромосомах. Масштаб 50 мкм.
----------------------------
Howard Hughes Medical Institute, Harvard Stem
Cell Institute, Department of Molecular and Cellular Biology, Harvard University,
7 Divinity Avenue, Cambridge, MA 02138, USA.
*To whom correspondence should be addressed. E-mail: Eggan@mcb.harvard.edu
Эта статья была опубликована 26 августа 2005 года в журнале Science (том 309) под заголовком "Nuclear Reprogramming of Somatic Cells After Fusion with Human Embryonic Stem Cells".
Перепрограммирование клеток может стать реальностью в ближайшей перспективе
Дизайн сайта разработан KN Graphics